淀粉样纤维作为一种典型的蛋白质聚集体,其分子构象变化与形成机制是理解一系列神经退行性疾病病理过程及开发功能性生物材料的核心科学问题。Ninjurin-1 (NINJ1)蛋白是多种类型细胞死亡的终末执行者,通过在细胞质膜上组装介导膜破裂。其N端两亲性α-螺旋被认为是执行该功能的关键结构域,之前的研究发现该结构域具有破膜特性,但相关分子机制尚不明确。
中国科学院物理研究所/北京凝聚态物理国家研究中心软物质物理实验室SM06组焦放特聘研究员聚焦于生物大分子在近生理环境下的动态结构与功能机制研究。近期,该团队结合常规和高速原子力显微镜、圆二色谱和冷冻电镜等技术系统阐明了NINJ1蛋白N端结构域衍生肽HE30的破膜机理及其构象变化形成淀粉样纤维的动态转变特性。
研究发现,单体HE30通过非溶孔性的"地毯式"机制与脂膜相互作用,诱导膜厚度减小,从而破坏细胞膜。此外,HE30在溶液中自发经历从α-螺旋到β-折叠的构象转变,并进一步组装形成淀粉样纤维。这些纤维展现出显著的环境响应性:在常温下主要形成非扭曲结构,而在升温条件下则转变为左螺旋形态,并可进一步组装成高阶超螺旋纤维束。酸性环境(~pH4.4)促进纤维组装,但碱性条件能使纤维可逆性解聚回到α-螺旋单体构象。通过原位原子力显微镜实时成像技术,揭示了HE30纤维的两端非对称性生长机制。结合冷冻电镜技术,解析了螺旋纤维的两种形态,揭示其交叉β-折叠核心结构是由疏水相互作用和静电相互作用共同作用的分子基础。此外,将HE30纤维作为温度响应型模板,成功引导金纳米粒子组装成直线型和螺旋型两种不同超结构,展现了其在功能材料领域的应用潜力。该研究不仅深化了对NINJ1介导质膜破裂机制的理解,也为新型淀粉样纤维功能材料的开发和应用打下基础。
相关研究工作以“Amyloid Fibrillation of a Ninjurin-1-Derived α-Helical Peptide: Structural Insights into Conformational Transition”为题发表在ACS Nano上,来自中国人民大学联合培养的博士研究生王美娇与中国科学院上海有机化学研究所博士研究生夏文程为本文共同第一作者,中国科学院物理研究所焦放特聘研究员、中国科学院上海有机化学研究所刘聪研究员与中国人民大学张建平教授员为共同通讯作者。该研究获得国家自然科学基金、中国科学院战略性先导科技专项等项目的支持。
文章链接:http://pubs.acs.org/doi/abs/10.1021/acsnano.5c14731
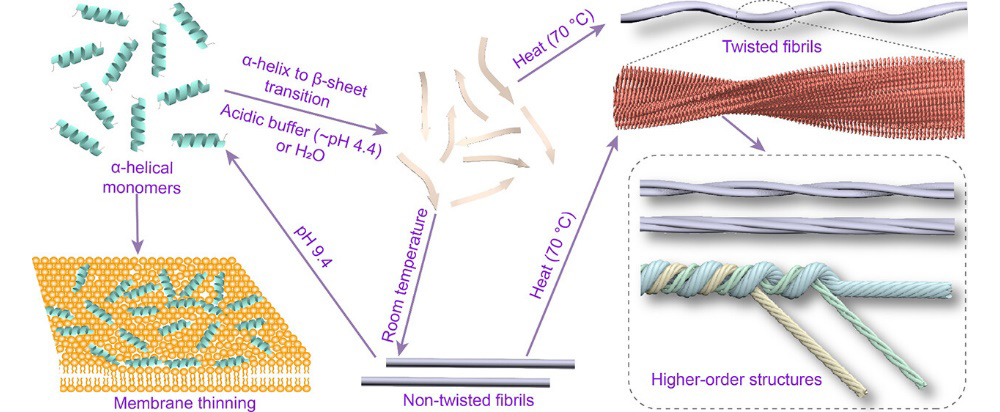
HE30自组装机制的示意图。单体HE30通过非溶孔性的"地毯式"机制与脂膜相互作用,诱导膜厚度减小;HE30经历α-螺旋到β-折叠的转变,分层组装成非扭曲原纤维、扭曲原纤维,以及形成高阶超螺旋结构。

