细胞是一种远离平衡的自组织系统,在膜边界的约束下持续进行能量与物质交换。从生物大分子出发构建单细胞生命,长期被视为科学界最具挑战性的目标之一。实现合成细胞的关键挑战在于重建膜相关功能,如选择性物质运输、跨膜能量转换与信号传递等,这些过程高度依赖细胞膜上正确折叠并稳定整合的膜蛋白。然而,膜蛋白通常含有多个疏水跨膜片段,在水相环境中易发生聚集、错折叠,尤其在缺乏转位酶等辅助因子的情况下,其功能化整合效率极低,严重制约了合成细胞的功能复杂度与稳定性。
中国科学院物理研究所/北京凝聚态物理国家研究中心软物质物理实验室SM4课题组长期致力于单分子核酸动态结构与生物界面物理研究。近期,该课题组在合成细胞中膜蛋白的原位合成与整合方面取得重要突破。研究团队以巨型单层脂质囊泡为合成细胞模型,借鉴天然细胞中“翻译—插入”协同机制,在国际上首次提出并实现了“膜近端空间约束mRNA翻译”新策略:通过将mRNA精准锚定于脂质膜表面,引导核糖体在膜附近富集,驱动疏水跨膜结构在翻译过程中直接插入脂质双层,从而显著提升膜蛋白的合成与功能整合效率。
该方法的创新之处在于,研究团队在目标膜蛋白mRNA的3′非翻译区(3′-UTR)嵌入一段特异性识别标签,并结合胆固醇修饰的单链DNA(chol-ssDNA)作为膜锚定元件。胆固醇基团自发嵌入囊泡膜,chol-ssDNA则稳定锚定于膜表面;当mRNA被转录并携带标签序列后,即可与膜上的chol-ssDNA通过杂交实现定位。该设计使得翻译过程被限制在膜表面纳米尺度范围内,新生肽链的疏水区域在离开核糖体后即可被附近的脂质双层快速捕获,从而避免在水相中聚集与错误折叠,大幅提高功能性膜蛋白的整合成功率。
实验结果表明,该系统可使多种跨膜蛋白在GUV膜上的整合效率提升约一个数量级,并成功实现如选择性小分子运输等功能验证。更为重要的是,该方法支持通过调节不同mRNA的膜锚定比例,实现膜蛋白组成的化学计量比精确调控,为构建具备可编程膜功能的合成细胞奠定了基础。该平台无需改造蛋白序列或核糖体,与现有无细胞表达系统完全兼容,具有高度的通用性与可扩展性。
此项研究的共同第一作者包括中国科学院物理研究所的博士后付航与马利娟,通讯作者为李明研究员与陆颖研究员。该工作得到了中国科学院战略性先导科技专项(XDB0480000)、国家重点研发计划、国家自然科学基金、科技部及中国博士后科学基金等项目的支持。相关成果发表在《Proceedings of the National Academy of Sciences of the United States of America》上,标题为“Spatially regulated mRNA translation enables functional membrane protein integration in synthetic cells”。文章链接 https://doi.org/10.1073/pnas.2517323123
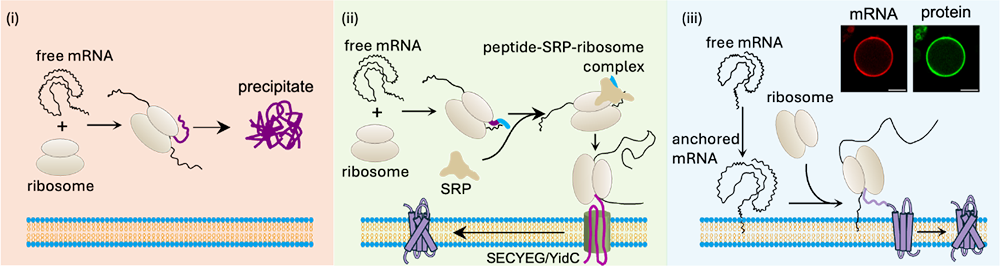
图:膜蛋白合成的三种模式:(i) 在水相溶液中,疏水性膜蛋白在翻译后易发生错误折叠并聚集;(ii) 在细胞内,膜蛋白的翻译与插入通过SRP通路实现共翻译介导;(iii) 本研究提出的mRNA膜近端翻译策略。

