在自然条件下,细胞时刻经历着胞外环境的波动,这些变化会显著改变胞内的生物物理性质,进而重塑细胞功能。在复杂的环境因素中,渗透压尤为关键,它直接参与调控细胞迁移、分裂、分化以及组织稳态等核心生命活动。过往研究表明,胞外渗透压能从多方面重塑细胞内的微环境,例如调节细胞膜张力、重构细胞骨架网络、改变细胞质内的分子拥挤度与扩散动力学等。然而,相比于细胞膜和细胞质,渗透压对“细胞指挥中枢”——细胞核的影响仍不明确。这主要是因为细胞核充满了高度折叠的染色质,内部极度拥挤且结构复杂。长期以来,由于缺乏能够精准定位到特定基因位点、且能实时感知局域物理微环境(如拥挤度)变化的探针,科学家们难以在活细胞中直接解析物理环境波动如何调控基因转录等关键功能,限制了该领域的深入探索。
近期,中国科学院物理研究所/北京凝聚态物理国家研究中心软物质物理实验室SM1组、北京师范大学系统科学学院李辉教授团队和南方医科大学荣知立教授团队合作,引入 dCas9-SunTag 系统作为探针,深入探索了特定DNA位点对胞外渗透压变化的响应规律。研究发现,胞外渗透压能像“开关”一样灵敏调控dCas9-SunTag系统对目标DNA的标记效率:低渗环境显著增加了基因位点标记点的数量与荧光强度,而高渗环境则产生相反效果。这种调控表现出即时性、可逆性和可重复性。更重要的是,该物理响应直接映射到了生物功能上。团队通过跨尺度测量系综水平的基因表达量和单分子水平的mRNA转录频率,证实基因转录效率对渗透压的响应模式与荧光标记完全一致。进一步机制解析表明,“核内分子拥挤度”是连接胞外物理信号与核内基因功能的关键。胞外渗透压的变化直接影响了细胞核内部的拥挤环境,进而调节了生物分子(无论是荧光蛋白还是转录因子)与 dCas9-SunTag 复合体之间的“结合-解离”化学平衡,最终实现了对DNA标记和基因转录的物理调控。
这项工作不仅揭示了胞外渗透压作为一种关键物理量,如何影响细胞核内基因行为的物理机制,更确立了 dCas9-SunTag 系统作为一种能够感知核内局域拥挤度的新型探针,为精准调控基因表达及探测细胞核对外界环境的动态响应提供了全新策略。
该工作以“Osmotic pressure regulates DNA labelling and transcription with dCas9-SunTag system in live cells”为题发表于Nature Communications 17, 773 (2026)。物理所窦硕星研究员、北师大李辉教授、南医大荣知立教授为共同通讯作者,物理所博士生魏坦琳和南医大博士生杨小凤为共同第一作者。研究得到了国家自然科学基金、中国科学院、广州国家实验室等项目的资助。原文链接:https://doi.org/10.1038/s41467-025-66160-6
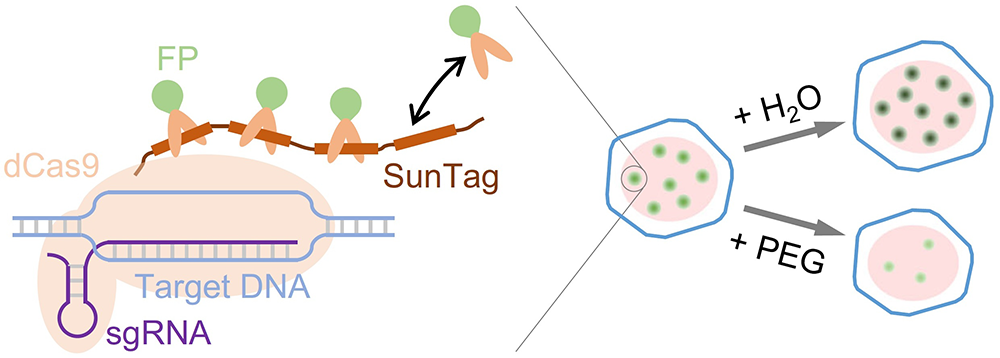
图 渗透压调控活细胞中dCas9-SunTag系统的DNA标记

